Naukowcy EPFL zaobserwowali zachowanie katalizatorów na poziomie cząstek podczas elektrolizy wody. Katalizatory odgrywają kluczową rolę w tej reakcji, w której woda rozpada się na wodór i tlen. Rzucając światło na mechanizm leżący u podstaw funkcjonalnej roli katalizatorów podczas reakcji, naukowcy dokonali ważnego odkrycia dla projektowania systemów magazynowania energii odnawialnej.
Jeśli odnawialne źródła energii mają kiedyś zastąpić paliwa kopalne, inżynierowie muszą znaleźć sposób na ich niezawodne przechowywanie na dużą skalę. Jedna z metod, którą obecnie badają liczni badacze, polega na przechowywaniu energii w postaci gazowej w ogniwach elektrolitycznych. Ogniwa elektrolityczne działają, wykorzystując energię elektryczną do wywołania reakcji elektrolizy, która powoduje rozszczepienie cząsteczek wody na wodór i tlen. Elektryczność można następnie odzyskać, odwracając reakcję i ponownie łącząc wodór i tlen w wodę.
Działanie katalizatorów
Katalizatory są wykorzystywane do przyspieszenia reakcji elektrokatalitycznych bez zużywania się w procesie. Katalizatory używane do elektrolizy wody to tlenki metali; niektóre z nich działają lepiej niż inne – chociaż dokładny powód pozostaje nieznany. – Byliśmy w stanie zauważyć, że podczas elektrolizy wody niektóre tlenki są szczególnie skuteczne, wytrzymałe i stabilne. Ale nie możemy tak naprawdę wyjaśnić, dlaczego te tlenki działają lepiej, ponieważ nie wiemy dokładnie, co dzieje się z katalizatorem podczas reakcji – mówi Vasiliki Tileli, adiunkt i kierownik Laboratorium Charakteryzacji Nanomateriałów w EPFL.
Katalizator nowej generacji
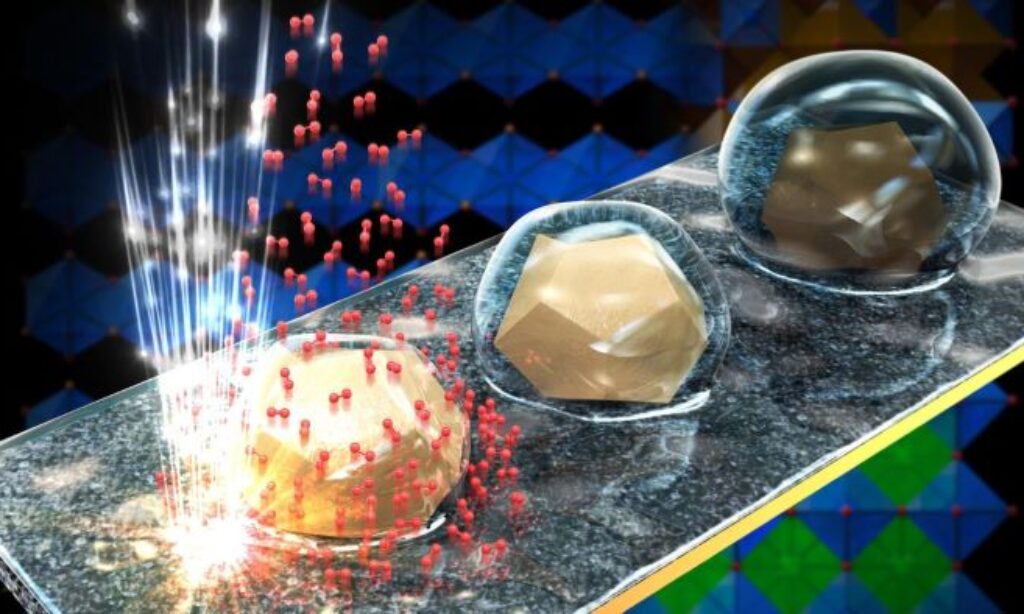
Aby się tego dowiedzieć, Tileli oraz Tzu-Hsien Shen (doktorantka w jej laboratorium), obserwowały reakcje elektrolizy wody pod mikroskopem elektronowym, badając zachowanie katalizatora podczas całego procesu i generując obrazy w skali nanoskopowej. Użyły katalizatora tlenkowego typu perowskit o nazwie BSCF. – To intrygujący katalizator o wyjątkowych właściwościach rozdzielania wody. Większość stosowanych obecnie katalizatorów, takich jak te z irydu i rutenu, jest skutecznych, ale bardzo drogich, a ich podaż jest ograniczona. W końcu trzeba będzie odkryć alternatywy – mówi Tileli.
Tileli i Shen wykonały w czasie rzeczywistym obrazy cząstek BSCF na każdym etapie cyklu elektrolizy. Zobaczyły pojawianie się tlenu cząsteczkowego, co oznaczało, że zachodziła reakcja, i potwierdziły, że proces jest odwracalny. Zauważyły również, że BSCF jest szczególnie solidny.
Powierzchnie, które zmieniają się z hydrofobowych na hydrofilowe
Ponadto zespół badawczy odkrył, że atomy powierzchni cząstek ulegają redystrybucji podczas reakcji, zmieniając właściwości powierzchni. W rezultacie cząstki w różny sposób oddziałują z otoczeniem na różnych etapach cyklu elektrolizy. Powierzchnia jest hydrofobowa (tj. odpycha wodę) na niektórych etapach, podczas gdy na innych jest hydrofilowa (tj. przyciąga wodę).
– Te obserwacje są wyjątkowe. Podejrzewaliśmy, że powierzchnia cząstek może się zmieniać, ale nigdy wcześniej nie zaobserwowano tego w skali nanoskopowej i w czasie rzeczywistym – mówi Tileli. Zdolność materiału do przełączania się między stanami hydrofobowymi i hydrofilowymi jest bardzo cenna dla inżynierów i może być wykorzystywana w różnych zastosowaniach, takich jak czujniki, systemy oczyszczania wody i powierzchnie samoczyszczące, w katalizie przyrodniczej.
Źródło: EPFL
Zaprenumeruj Magazyn Fotowoltaika